研究ハイライト
光からエネルギーを取得し、タンパク質を合成する人工細胞
-より生物に近い機能を持つ人工細胞が誕生-
【要点】
○ 光エネルギーからATPを合成する人工細胞小器官を作製
○ 人工細胞小器官を持った人工細胞が光によりタンパク質を合成
○ 光駆動型のバイオデバイス開発につながる可能性
【概要】
|
東京工業大学 地球生命研究所(ELSI)の車兪澈(くるま ゆうてつ)特任准教授と東京大学大学院新領域創成科学研究科の博士課程大学院生Samuel Berhanu(サミュエル・ベルハヌ)、上田卓也教授は、光をあてるとタンパク質を作り出すことができる人工細胞(注1)の作製に成功した。 人工細胞は、脂質膜の中でDNAからタンパク質を合成する擬似的な細胞だ。これは、非生物である物質や遺伝情報から、生命現象が創発する過程を再現できるとして期待されている。しかし、これらの反応は、あらかじめ供給したエネルギー源を消費して反応を行うだけのもので、実際の細胞のようにエネルギー源であるATP(注2)自体を生産することはできなかった。 研究グループは今回、光をあてるとATPを生産する植物の葉緑体のような細胞小器官(注3)を人工的に作製し、これを人工細胞に組み入れることで、光エネルギーからタンパク質を合成することに成功した。さらにこの方法を用いて細胞小器官を構成している膜タンパク質を合成できた。より生物に近い、エネルギー的に自立した人工細胞の実現に道が拓けた。 本成果は、2019年3月22日付の「Nature Communications」に掲載された。 |
●研究成果
我々人間が日々の生活で電気を消費して生きているように、細胞もATPと呼ばれるエネルギー源を消費して生きている。ATPは通常呼吸や光合成により細胞内で生産される。
車特任准教授らは、光エネルギーを利用してATPを生産する、直径約100~200nm(nmは、1mmの100万分の1)の人工細胞小器官(注4)を生み出した。
光照射により生産したATPを遺伝情報伝達分子(mRNA(注5))の材料として、または翻訳のエネルギーとして消費することで、DNAからタンパク質を合成する人工細胞を作製した。これにより、光という物理的なエネルギーを、情報伝達分子や機能性高分子に変換することが人工細胞系で可能になった。さらに反応産物として人工細胞小器官の部品となるタンパク質を合成することで、実際の生物と同じ様に自身のパーツを生み出すことに成功した。
●背景
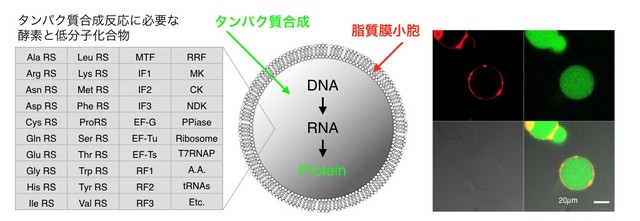
近年、生体分子や遺伝子を人工的に組み合わせることで、分子から生きた細胞を創る研究が合成生物学の分野で進められている。人工細胞は、脂質から形成されるカプセル状の膜小胞の内に、タンパク質合成反応に必要な36種類の酵素とリボソーム、低分子化合物などを封入して、膜の中でタンパク質を合成する擬似的な細胞だ(図1)。このように最小限の因子から構成される細胞は、生きるために必要な最小限の機能や遺伝子をボトムアップ的に実証することになるため、合成生物学やゲノム科学の分野で大きく注目されている。また、地球上に生物、すなわち細胞が誕生したばかりの初期の様相を反映していると考えられていることから、生命の起源を探究する新しい側面を担う研究としても注目される。
これまでの人工細胞は、生体エネルギー源となるATPを一緒に内封し、それを使い切ることで細胞のような振る舞いを再現してきたが、外部の物理的・化学的エネルギーからATPそのものを自立的に生産することはできなかった。
図1. 脂質膜小胞の内部でタンパク質を合成する人工細胞(右)。
●研究の経緯
細胞内のATPは主に細胞膜、またはミトコンドリア内膜に存在するATP合成酵素(注6)によって合成される。ATP合成酵素が働くためには、あらかじめ膜内外のプロトン濃度勾配を形成する必要があり、これが直接のエネルギーとなる。プロトン濃度勾配は通常、呼吸や光合成による電子伝達系を経て形成される。 研究グループは、好塩菌から単離したバクテリオロドプシン(bR)(注7)が光エネルギーからプロトン濃度勾配を形成することに着目し、bRとATP合成酵素を組み合わせることで、光によってATPを合成する人工細胞小器官を作製した(図2)。直径数百nmほどのこの人工細胞小器官を、細胞と同じくらいのサイズの大きな膜小胞(GUV(注8))に閉じ込めて光を当てたところ、実際の細胞内と同じレベルのATPを人工膜の中に合成することができた。
このように光で合成したATPを、転写(DNAからmRNAを合成する反応)の基質や、翻訳(mRNAからタンパク質を合成する反応)のエネルギーとして利用することで、光からタンパク質を合成する人工細胞を設計した。人工細胞はGUVの中に無細胞タンパク質合成系(無細胞系(注9))を封入することでできる擬似的な細胞である。今回利用した無細胞系は、転写・翻訳反応に関わる36種類の酵素とリボソーム、様々な低分子化合物から組み立てた、再構築型の無細胞系である。ここからATPを取り除き、代わりにその前駆体であるADPを加えることで光によりATPを作る人工細胞をデザインした。
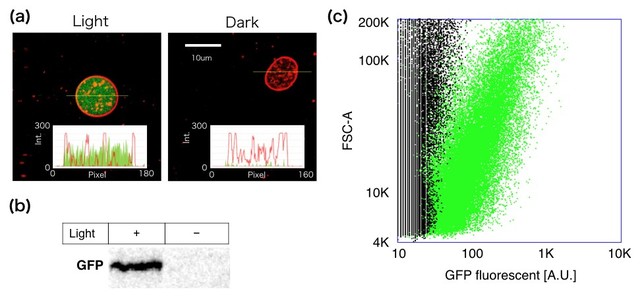
具体的には、光合成したATPからmRNAを合成し、翻訳と合わせることでGFP(緑色蛍光タンパク質)を合成した。また、アミノ酸をtRNA(注10)に結合する際のエネルギーとして、または翻訳の直接的なエネルギー源であるGTP(グアノシン3リン酸)を合成するためのエネルギーとしてATPを消費することでGFPを合成した(図3)。生きた細胞の中ではATPを細胞内諸反応のエネルギー源として、あるいはmRNAの基質として消費している。そのため、今回、生きた細胞と同じことを人工細胞系で再現した事になる。
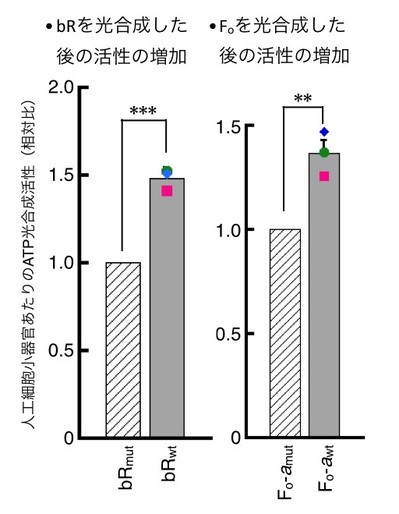
さらに、光合成されたATPからbRを合成することで、人工細胞小器官のATP合成活性を強化するような人工細胞をデザインした。合成されたbRは人工細胞内部の人工細胞小器官に組み込まれることでATP合成量が約1.5倍上昇。同じように、ATP合成酵素の膜部分(Fo)を光合成することで、約1.4倍上昇した(図4)。このことは、自分で自分のパーツを作ることで、細胞と同じような正のフィードバック構造を再現したことを意味する。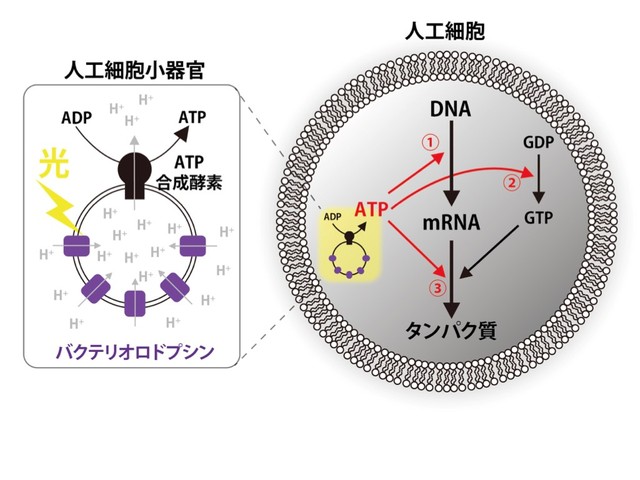
図2. ATP合成酵素とバクテリオロドプシンからなる人工細胞小器官と、それを含む人工細胞の概念図。
図3. (a)光によりGFPを合成する人工細胞と、(b)合成されたGFPのタンパク質電気泳動による可視化。 (c)光を当てた人工細胞の内、約60%が有意GFPを合成した。
図4. bRまたはFoの光合成による人工細胞小器官の活性の増加。bRmutまたはFo-amutは活性を欠損した変異体であるため、光合成後も人工細胞小器官の活性は変化しない。
●今後の展開
消費された後のATPはADPとリン酸に分解される。今回構築した人工細胞小器官は、このADPに再度リン酸をチャージし、再利用することができる。このようなエネルギーリサイクル系を人工細胞に組み込むことで、長期間反応を行う寿命の長い人工細胞ができると期待される。
タンパク質合成反応以外にも、ATPを反応エネルギーとして利用する数多くの細胞内反応を、本当の細胞に近い時空間条件で再現することができる。そのほかにも、光で生化学反応を制御するバイオデバイスの開発など、将来的な産業応用も期待できる。
【用語説明】
(注1)人工細胞:直径数μmから数十μmマイクロメートルの膜小胞の内部でタンパク質を合成する擬似的な細胞。内部に無細胞系を持つ。
(注2)ATP:アデノシン3リン酸。アデノシンに3分子のリン酸が結合したエネルギー貯蔵分子。細胞内での様々な反応に消費される。
(注3)細胞小器官:細胞内部にある様々な機能を持つ構造体。ミトコンドリアや、葉緑体などがこれにあたる。
(注4)人工細胞小器官:バクテリオロドプシンとATP合成酵素を直径約100~200nmの脂質膜(リポソーム)に構成した人工的な細胞小器官。光をあてることで、バクテリオロドプシンがリポソーム内に水素イオン(プロトン)を輸送し、これにより形成されたリポソーム内外のプロトン濃度勾配がATP合成酵素を駆動させることでATPを合成する。
(注5)mRNA:伝令RNA。タンパク質を合成するため、DNAの持つ遺伝情報をコピーしたRNA。
(注6)ATP合成酵素:膜を介したプロトン濃度勾配をエネルギーとして、ADPとリン酸からATPを合成する酵素。F型のATP合成酵素は3種類の膜タンパク質と5種類の細胞質タンパク質から構成される。
(注7)バクテリオロドプシン(bR):高度好塩菌が紫色の細胞膜上に持つ7回膜貫通型の膜タンパク質。光をあてると内部のレチナールが異性化し膜の反対側へプロトン分子をポンプする。
(注8)Giant Unilamellar Vesicle (GUV):巨大膜小胞。リン脂質から構成されるカプセル状の膜構造。内部中空になっており様々な分子を内包することができる。
(注9)無細胞系:試験管内でDNAの持つ遺伝情報から転写翻訳を経てタンパク質を合成するバイオテクノロジーツール。個々の因子から再構築したものはPURE systemと呼ばれる。
(注10)tRNA:転移RNA。mRNA上の3つ文字記号を解読し、対応するアミノ酸をリボソームに運ぶ73~93塩基のRNA。
【論文情報】
掲載誌:Nature Communications
論文タイトル:Artificial photosynthetic cell producing energy for protein synthesis
著者:Samuel Berhanu, Takuya Ueda, Yutetsu Kuruma
DOI:10.1038/s41467-019-09147-4
【問い合わせ先】
東京工業大学 地球生命研究所 特任准教授
車 兪澈(くるま ゆうてつ)
Email: kuruma_at_elsi.jp
TEL: 03-5734-2708
FAX: 03-5734-3416
【取材申し込み先】
地球生命研究所研究所(広報担当)
Email:pr_at_elsi.jp
Tel: 03-5734-3163
Fax: 03-5734-3416
※このページは、東京工業大学公式サイトのこちらのページの情報を編集・転載したものです。