研究ハイライト
35億年前の地球に、生命繁栄の証拠を確認
要点
○ 約35億年前の太古代地球に硫酸塩還元細菌が広く繁栄していたことが判明
○ 代謝経路に働く酵素によって生じる硫黄安定同位体分別を実験的に再現
○ 地球化学に細胞の代謝酵素という異分野の知識を融合することで実現
概要
ELSIのShawn E. McGlynn准教授、ソウル大学校 地球環境科学部のMin Sub Sim助教、北海道大学 低温科学研究所の緒方英明特任准教授らの研究グループは、約35億年前の太古代の地球に硫酸塩還元(用語1)細菌が広く繁栄していたことを突き止めた。硫酸塩を代謝して呼吸(用語2)を行う硫酸塩還元細菌の代謝経路に働く酵素によって生じる硫黄安定同位体分別を実験的に再現して解明した。
現生の硫酸塩還元細菌を培養し、細菌の代謝に起因する硫黄安定同位体分別を、太古代の海底堆積物に記録された硫黄安定同位体分別と比較することで、太古代の硫酸塩還元細菌が硫酸塩をどの程度代謝していたか、細菌の細胞内で代謝速度がどのように制御されていたかを確認した。
これにより、太古代には硫酸塩還元細菌が広く繁栄していたことが初めて明らかになった。また地球化学に細胞の代謝酵素という異分野の知識を融合することで、太古代の地球環境を理解するための指標を得ることができた。
35億年前の地球は無酸素環境だったが、既に生命が存在し、その一部が硫酸塩還元細菌だったことは以前から知られていた。しかし硫酸塩還元細菌が当時の環境下でどの程度成功した生物であったのか、どのような生命活動を行っていたのかは謎だった。
研究成果は1月9日発行の英国の国際学術誌「Nature Communications(ネイチャーコミュニケーションズ)」電子版に掲載された。
 AprによるAPS中の硫黄原子の還元について説明するMcGlynn准教授(クレジット:ELSI)
AprによるAPS中の硫黄原子の還元について説明するMcGlynn准教授(クレジット:ELSI)
研究の背景
生命はいつ、どのように誕生し、この地球でどのように生きてきたのだろうか。例えば恐竜のように大型で現在に比較的近い時代に生きた生物なら、化石を発見することで姿や生活の様子を知ることができる。
しかし、今から約40億~25億年前、太古代と呼ばれる時代に存在したとされるごく最初期の生命は、わずか1個の細胞からなる単細胞生物であったため、化石が得られることは非常に稀である。この時代に生物が存在したことを確認し、活動の様子を推定する手掛かりとなるのが、当時の海底堆積物に残された安定同位体である。
同位体とは、同じ元素でありながら中性子の数が異なる原子をいう。水素を除くすべての原子は原子核の中に陽子と中性子の2種類の粒子を持っており(水素原子は通常、中性子を持っていない)、陽子の数によって原子の種類が決まっている。例えば炭素原子なら陽子の数は必ず6個、酸素原子なら8個である。
しかし中性子の数は同じ種類の原子の中でも必ずしも一定とは限らない。例えば炭素原子では多くの場合、中性子の数は陽子と同じ6個だが、中性子を7個持つ原子、8個持つ原子も一部存在する。陽子の数は同じだが中性子の数の異なる原子を同位体という。陽子と中性子の数の和を質量数といい、中性子を6個持つ炭素原子の質量数は12、中性子7個なら13である。これらはそれぞれ炭素の原子記号Cと合わせて12C、13Cのように表される。
同位体の多くは不安定であり、短いものでは1秒以下の寿命しか持たずに崩壊して別の原子に変化する。しかし一部は安定で、変化することなく環境中に残り続ける。炭素の場合、12Cと13Cが安定同位体である。
自然界における安定同位体の比率は元素ごとにほぼ一定である。しかし、中性子の多い同位体は少ない同位体と比べて中性子の数の分だけ重いため、中性子の少ない同位体と比べて微生物の体に取り込まれにくい傾向がある。このため、生命活動によって生成された物質には、生命活動に使用されなかった物質と比べ、軽い同位体が含まれている可能性が高くなる。このように何らかの理由によって、安定同位体の比率が通常の状態から変化することを安定同位体分別と呼ぶ。
今回、研究の対象とした硫酸塩に含まれる硫黄原子には、32S、33S、34Sの3種類の安定同位体が存在する。太古代の堆積物の安定硫黄同位体比(34S/32S)は既に測定されているが、微生物の硫酸塩還元の結果として推定される硫黄同位体分別よりも、分別量がかなり小さいことが問題となっていた。
当時の硫酸塩還元細菌は、現生のものと比べて不活発だったのだろうか。当時の環境には十分な硫酸塩がなく、細菌は飢えていたのだろうか。研究グループは微生物による数段階の硫酸塩還元プロセス(用語3)のうち、ある特定の反応に関わる酵素(Apr=APS還元酵素、アデノシンホスホ硫酸レダクターゼ)に着目し、Aprによる硫黄同位体分別を堆積物のものと比較して、堆積物中の同位体分別量が小さい理由を推定した。
研究成果
酵素Aprによる同位体分別は、堆積物の同位体分別に酷似していた。さらに数値シミュレーションにより、硫酸塩の還元に必要な電子が環境中に充分供給されない場合、Aprによる還元反応の速度が低下することもわかった。硫酸塩から硫化物に至る代謝の過程で使用される酵素はAprの他にもあるが、堆積物のものと類似した同位体分別(物質によって同位体の比が変わること)を持つものはこれまで見つかっていなかった。また、Aprによる反応は硫酸塩の代謝速度全体を制御する重要な反応であるが、この反応による同位体分別はこれまで調べられていなかった。
以上の成果に基づき、研究グループは、Aprによる反応は硫酸塩還元の律速段階(用語4)であること、また、35億年前の堆積物中の硫黄同位体分別値とAprによる同位分別値が酷似していたことから、Aprによる還元反応に必要な電子を供給する電子ドナー(用語5)が環境中に充分存在し、太古代に硫酸塩還元細菌の還元反応が活発かつ安定的に行われていたと解釈した。
硫酸塩還元細菌は、エネルギー源となる硫酸塩の不足に苦しんでいたわけではなく、硫酸塩の代謝に必要な電子を豊富に確保して、広く繁栄していた可能性が高いことが推定できた。これは、微生物の細胞の中で行われる化学反応が、堆積物中に同位体比として記録されていることが数値的に確認できた初めてのケースである。
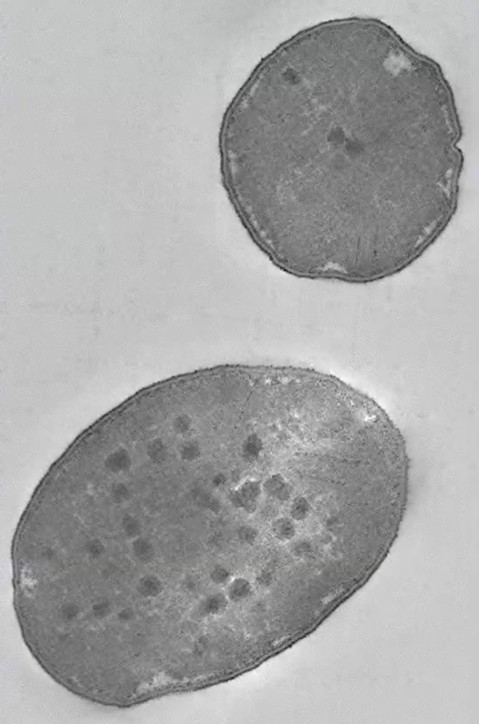 図1.硫酸塩還元を行う単細胞微生物の顕微鏡写真(クレジット:Guy Perkins and Mark Ellisman, National Center for Microscopy and Imaging Research)
図1.硫酸塩還元を行う単細胞微生物の顕微鏡写真(クレジット:Guy Perkins and Mark Ellisman, National Center for Microscopy and Imaging Research)
 図2.微生物による硫酸塩還元によって生じた硫化物を含む鉱物(黄鉄鉱(FeS2))(クレジット:ELSI 上野雄一郎)
図2.微生物による硫酸塩還元によって生じた硫化物を含む鉱物(黄鉄鉱(FeS2))(クレジット:ELSI 上野雄一郎)
今後の展望
今回の研究では硫酸塩還元細菌という微生物の1グループの、1つの酵素について、同位体分別を測定した。しかし、同位体分別を起こす微生物種はこの1グループのみではない。太古代から現在に至るまでに登場した多くの微生物種について、生化学と堆積物記録を比較することで、微生物同士の生命活動の類似度や堆積物が堆積した当時の古環境を知ることができる。
Shawn E. McGlynn准教授は、地球化学と生物学、さらにはシミュレーションを融合させたこの新しい研究分野を「進化的及び同位体的酵素学」と呼び、酵素反応の理解が地球史の解明に今後一層寄与することを期待している。
用語説明
(1)還元:物質が水素、または電子を得る化学反応をいう。
(2)呼吸:人類を含めた多くの生物は、糖を二酸化炭素に分解することで生命活動に必要なエネルギー(ATP)をつくり出している。この分解の過程では有機物から水素が分離され、その水素から電子が分離されて、酸素に渡される。電子の受容体としての酸素を体内に取り込み、糖の分解で生成された二酸化炭素を吐き出す過程が、酸素呼吸(好気呼吸)である。しかし、酸素が不十分、または全くない状態でも、一部の微生物などは、酸素以外の物質を電子受容体として呼吸を行うことができる。硫酸塩還元細菌は、硫酸塩の分解で生じる硫酸イオンを電子受容体として利用してエネルギーを生成し、硫化物(硫化水素など)を排出する。
(3)硫酸塩還元プロセス:硫酸塩とは、硫酸イオン(SO42-)を含む無機化合物である。硫酸イオンは安定性の高いイオンで、このままの状態では還元反応が起こりにくいため、代謝過程ではまずATPを使用して、硫酸イオンを反応性が高く高エネルギーを持つアデニリル硫酸(APS)に変化させる。APSはApr(APS還元酵素)により還元されて亜硫酸塩となり、亜硫酸塩は別の酵素で還元されて、硫化物イオン(S2-)となる。
(4)律速段階:いくつかの段階を経て進む化学反応で変化速度が最も遅い反応のこと。この反応速度で全体の反応速度が決まる。
(5)電子ドナー:硫酸塩の還元を充分に、かつ速やかに行うためには、豊富な電子が必要となる。海水中では水素などが電子ドナーとなり得るが、太古代の海水中には硫酸塩還元細菌の他にメタン生成菌や酢酸生成菌などの細菌が存在し、それらの細菌も代謝のための電子ドナーとして水素を必要としたと考えられている。堆積物の硫黄同位体分別がAprのものと類似していたことは、硫酸塩還元細菌が電子ドナーの獲得において他の細菌より優位に立っていたと解釈できる。
論文情報
| 掲載誌 | Nature Communications |
| 論文タイトル | Role of APS reductase in biogeochemical sulfur isotope fractionation |
| 著者 | Min Sub Sim1,2*, Hideaki Ogata3,4, Wolfgang Lubitz3, Jess F Adkins2, Alex L Sessions2, Victoria J Orphan2, Shawn E McGlynn2,5* |
| 所属 | 1. School of Earth and Environmental Sciences, Seoul National University, South Korea 2. Division of Geological and Planetary Sciences, California Institute of Technology, USA 3. Max Planck Institute for Chemical Energy Conversion, Germany 4. Institute of Low Temperature Science, Hokkaido University, Japan 5. Earth-Life Science Institute, Tokyo Institute of Technology, Japan |
| DOI | 10.1038/s41467-018-07878-4 |
| 出版日 | Jan. 9, 2019 |
※このページは、東京工業大学公式サイトのこちらのページの情報を編集・転載したものです。
お問い合わせ
【問い合わせ先】
東京工業大学 地球生命研究所 准教授
Shawn E. McGlynn(ショーン・E・マクグリン)
Email:mcglynn@elsi.jp
<日本語での問い合わせはこちら>
北海道大学 低温科学研究所 特任准教授
緒方英明(おがた ひであき)
Email:hideaki.ogata@pop.lowtem.hokudai.ac.jp
【取材申し込み先】
東京工業大学 広報・社会連携本部 広報・地域連携部門
Email:media@jim.titech.ac.jp
TEL:03-5734-2975 FAX: 03-5734-3661