研究ハイライト
機能性細胞膜の合成に成功、人工細胞にむけて大きな一歩~完全制御可能な膜タンパク質合成システムの実現に道~
東京工業大学
東京大学
要点
○タンパク質を膜透過させる細胞膜上のトンネル「SecYEGトランスロコン」を試験管内で作製
○SecYEGトランスロコンを介して数種の膜タンパク質を人工脂質膜に挿入
○細胞膜の機能を自律的に合成する人工細胞の実現に期待
概要
東京工業大学地球生命研究所の車兪澈(くるま ゆうてつ)WPI(世界トップレベル研究拠点プログラム)研究員、東京大学大学院新領域創成科学研究科の上田卓也教授と松林英明大学院生の研究チームは、人工細胞の構築に必要な、タンパク質を細胞膜に正確に組み込む分子装置を試験管内で作製することに成功した。上田教授が開発した試験管内タンパク質合成システム(PURE system、用語1)を用いて、膜タンパク質の合成に必須な膜上の分子装置を作製し、細胞と同じプロセスで膜タンパク質を合成した。この成果は、自律的に膜タンパク質を合成する人工細胞だけでなく、完全に制御可能な膜タンパク質合成システムの実現につながるものである。
生きた細胞の仕組みを詳細に理解するために、DNA、タンパク質、脂質などの生体分子を組み合わせて人工細胞を作製する研究が注目されている。しかし、それら細胞内分子を包み込む細胞膜の作製は、細胞膜上で働く膜タンパク質をうまく合成する有効な方法がなかったため非常に難しく、これまで人工細胞の実現を妨げていた。
この成果はドイツ化学会誌「アンゲヴァンテ・ケミー・インターナショナル・エディション」のオンライン速報版で2014年6月4日に掲載された。
研究成果
研究チームは、タンパク質を膜透過させるためのトンネル「SecYEGトランスロコン」(用語2)を、部品となる数種のタンパク質から組み立てることに成功した。それらのタンパク質を試験管内で合成することで、脂質膜上に組み立てられることを見いだした。このように人工的に作製したSecYEGトランスロコンは、細胞内と同様、さまざまなタイプのタンパク質を膜内へ挿入、膜外へ透過することが確認できた。 これら一連の反応は試験管内に関係遺伝子を投入するだけで行えるため、リポソーム(用語3)内でタンパク質合成を行う人工細胞実験(用語4)へすぐにでも応用できる。これにより、細胞膜機能を自律的に合成する人工細胞の実現が原理的に可能になった。
背景
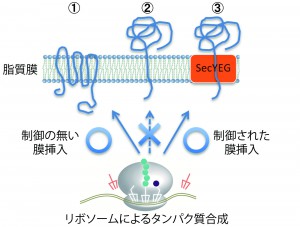
図1 制御の無いタンパク質の膜挿入と、SecYEGにより制御された膜挿入
ある種の膜タンパク質はリボソーム上でのタンパク質合成とカップルして自発的に膜挿入することができる①。しかし、これは制御の無い膜挿入であるため、膜の反対側に大きな構造を持つ膜タンパク質は正しく膜挿入できない②。そのため、膜の反対側に通すための孔であるSecYEGトランスロコンが必要になる③。
細胞は、DNA上に記録された遺伝情報からRNAやタンパク質を合成することで、さまざまな生体機能や構造を作り出している。タンパク質の中には細胞内で機能するもののほかに、細胞を包み込む細胞膜上で機能するもの、あるいは膜の外に放出されてから機能するものがある。しかし、このような膜を介するタンパク質は細胞の中で合成されるため、合成と同時に細胞膜に埋め込まれるか、または合成後に細胞膜の外へ透過される必要がある。その際、膜タンパク質は、Secトランスロコンと呼ばれる細胞膜上のトンネルを通過して、本来あるべき場所で正しい構造をとり機能する。 これまで研究チームは、試験管内でタンパク質を合成できるPURE systemと呼ばれるシステムにDNAを加えることにより、さまざまなタンパク質を合成してきた。PURE systemは、脂質から構成されるリポソームの内部でもタンパク質を合成できるため、人工細胞の研究に多く利用されている。 しかし、膜タンパク質を制御された状態で人工膜に組み込むことは難しく(図1)、限られた成功例しか報告されていなかった。膜タンパク質の多くは細胞の生命活動維持に必須であるため、人工細胞の実現のために避けては通れない問題だった。
ある種の膜タンパク質はリボソーム上でのタンパク質合成とカップルして自発的に膜挿入することができる①。しかし、これは制御の無い膜挿入であるため、膜の反対側に大きな構造を持つ膜タンパク質は正しく膜挿入できない②。そのため、膜の反対側に通すための孔であるSecYEGトランスロコンが必要になる③。
経緯
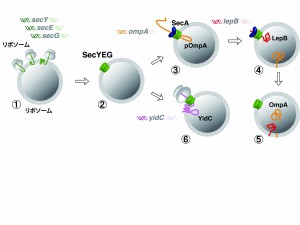
図2 試験管内でのSecYEGトランスロコンの合成と、SecYEGを介したpOmpA、LepBの膜透過と、YidCの膜挿入
試験管内タンパク質合成系であるPURE systemにリポソームを加え、SecYEGを合成するための遺伝子secY、secE、secGを投入する①②。SecYEGが合成された後、pOmpAを合成するための遺伝子ompAと、pOmpAを膜の内側へ透過させる細胞質因子SecAを投入する③。透過されたpOmpAはリポソーム内側の脂質膜に固定される。その後、LepBを合成するための遺伝子lepBを投入し同じように膜透過させる④。膜透過したLepBは先に透過したpOmpAの根元を切断し、結果成熟体型のOmpAがリポソーム内空間に放出される⑤。また、SecYGEは多数回膜を貫通するYidCを膜内へ挿入させることもできる⑥。
同研究チームは、大腸菌のSecトランスロコンであるSecYEGをPURE systemで合成し、タンパク質を正確に膜透過・膜挿入できる人工膜を構築した(図2)。まず、「SecY」、「SecE」、「SecG」の3つのタンパク質を直径約100nm(ナノメートル)のリポソームを含んだPURE systemで合成した。リポソームの外側で合成されたこれら3つのタンパク質は、合成と同時にリポソームの膜にくみ込まれ、「SecYEG」という複合体を形成する。 その後、SecYEGを通って膜の向こう側へ輸送される「pOmpA」(外膜構成タンパク質A前駆体、用語5)というタンパク質を合成し、「SecA」(用語6)という因子によってリポソームの内側へ膜透過させた。さらに、同じようにSecYEGを通る「LepB」(シグナル配列切断酵素、用語7)を合成・膜透過させたところ、先に通った膜上に固定されているpOmpAの一部を切断し、成熟体型の「OmpA」を生成したことが確認できた(図3)。また、SecYEGは膜を通り抜けるタイプのタンパク質に作用するだけではなく、「YidC」(用語8)のような膜を何回も貫通する複雑な構造の膜タンパク質にも作用していることが確認できた。 つまり試験管内で人工的に合成したSecYEGは、細胞内のSecYEGと同じように機能していることが証明された。これは世界で初めてSecトランスロコンを試験管内で人工的に合成した事例である。さらに今回の研究を通して、SecY変異体「C385Y」(用語9)がこのような人工的な系で、2〜5倍の高い膜透過活性を持つことを見いだした。このことも、今後の人工細胞の構築に大きく貢献するものである。
展開
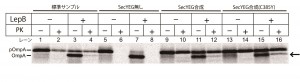
図3 電気泳動実験によるLepB合成によるpOmpAのシグナル配列切断の検出
SecYEG合成後にpOmpAを膜透過させ、さらにLepBを膜透過させた(レーン11と12、または15と16)。反応後、リポソームの外側のタンパク質をタンパク質分解酵素(PK)により分解することで、リポソーム内側に膜透過されたpOmpAのみを観察した(レーン12または16)。その結果、LepBによりシグナル配列が切断されたOmpAの生成が確認できた。C385Yは高い活性を持つSecY変異体C385Yを用いた実験。
SecYEGの合成と、その後のいろいろな膜タンパク質の合成。これらの反応はすべて、膜タンパク質をつくるためのDNAをPURE systemに加えただけで成功した。同研究チームはごく近い将来、同じ反応を細胞サイズのリポソームの中で行うことが可能であると考えている。これにより、自らSecYEGを合成し、細胞の生命活動維持に必要なさまざまな膜タンパク質をつくれる人工細胞の構築が可能になると期待される。 さらに、pOmpAの一部が切断された結果から、ホルモンのようなほかの細胞へ信号を伝搬するシグナル分子を送信できる人工細胞、あるいはそれらを受信できる人工細胞の構築が可能になることも考えられる。これにより、細胞1個のレベルでの人工細胞の構築ではなく、多細胞間のコミュニケーションも再現できる人工細胞群の構築も実現できると期待される。 また本研究の成果は、完全に制御可能な試験管内膜タンパク質合成システムの構築につながるものである。
用語説明
(用語1) 試験管内タンパク質合成システムPURE system タンパク質合成に必要な37種類の因子をそれぞれ大腸菌から単離精製し、1つの試験管内に混合したタンパク質合成のための人工的なシステム。目的の遺伝子を投入し温めることで、数時間以内にタンパク質が合成できる。
(用語2) SecYEGトランスロコン 細胞膜上にあるタンパク質を膜透過、膜挿入させる孔。大腸菌の場合、SecY、SecE、SecGが1:1:1で複合体を形成する。
(用語3) リポソーム 脂質膜から構成されるカプセル状の小胞。サイズは数百 ナノから数十マイクロメーター。
(用語4) 人工細胞実験 リポソーム内部に試験管内タンパク質合成系と目的の遺伝子を封入しタンパク質発現を行う疑似細胞。
(用語5) pOmpA(外膜構成タンパク質A前駆体) 大腸菌の外膜を構成するポリンタンパク質の前駆体。生合成の過程で内膜を通過する。その後、先端の約20アミノ酸配列(シグナル配列)が切断され成熟体型のOmpAとなって外膜に運ばれる。
(用語6) SecA タンパク質をSecトランスロコンを介して膜通過させるモータータンパク質。ATPをエネルギーとする。
(用語7) LepB(シグナル配列切断酵素) pOmpAのシグナル配列を切断する酵素。内膜と外膜の間であるペリプラズム領域で作用する。
(用語8) YidC 細胞膜上に存在する6回膜貫通型の膜タンパク質。小さい膜タンパク質の膜挿入を促す働きや、他の膜タンパク質の立体構造形成を助ける働きが知られている。
(用語9) C385Y SecYタンパク質の385番目のアミノ酸をシステイン(C)からチロシン(Y)に変えた変異体。